MARCO TEÓRICO EJERCICIOS Y OBJETIVOS DE OXIDO HIDRÓXIDOS SALES
Y SUS NOMENCLATURAS
CON EL SIGUIENTE VÍDEO VAN A TENER UNA EXPLICACIÓN MAS CLARA PARA DESPEJAR SUS DUDAS E INQUIETUDES:
ÓXIDOS BÁSICOS
Son compuestos con elevado punto de fusión que se forman como consecuencia de la reacción de un metal con él oxigeno.
SU NOTACIÓN
Los óxidos tienen la siguiente formula, que se aplica a todas las combinaciones por ejemplo X2On:,
donde X es el símbolo del elemento,
el 2 corresponde a la valencia del oxígeno,
la O es el símbolo del Oxígeno
la n es la valencia del elemento metálico.
Los óxidos básicos se forman por un
metal + oxígeno = óxido básico
SU NOMENCLATURA
los compuestos inorgánicos tienen tres tipos de nomenclatura
Nomenclatura sistemática o estequiometrica :se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molecula.
Nomenclatura tradicional, clásica o funcional : En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos.
Stock : Tambien llamada IUPAC. Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”.
EJEMPLOS:
1.¿ Qué pasa con el HIERRO ?
Aquí encontraremos algo nuevo: el HIERRO tiene dos números de oxidación, el 2 y el 3, de acuerdo a como reaccione con el oxígeno actuará con uno u otro número de oxidación. Si actúa con Nº de oxidación: 2
Fe + O2 ----FeO
Hierro Oxígeno Óxido Ferroso
Si actúa con Nº de oxidación: 3
Fe + O2---- Fe2O3
Hierro Oxígeno Óxido Férrico
En aquellos que tienen dos estados de oxidación utilizamos la palabra óxido, seguida por la raíz (primer parte) del nombre del elemento y una terminación que diferencia a ambos estados de oxidación
2 .K + O2 ---K2O
Potasio Oxígeno Óxido de potasio
3 .Mg + O2--- MgO
Magnesio Oxígeno Óxido de magnesio
Indique el número de óxidos básicos y óxidos ácidos respectivamente en la siguiente tabla:
a) Fe2O3
b) CO
c) SO3
d) CuO
e) NO2
f) Na2O
g) MgO
Solución:
Comenzaremos diciendo que el óxido se forma con la combinación quimica del oxígeno con otro elemento químico:
Oxígeno + Elemento Químico → Óxido
Existen dos tipos de óxidos:
Óxidos básicos: Combinación química del oxígeno con un metal Óxidos ácidos: Combinación química del oxígeno con un no metal
Hasta el momento hemos repasado la teoría y vemos que no es nada del otro mundo. Vayamos al ejercicio y definamos si cada uno de los elementos que acompañan al oxígeno es metal o no metal.
a) Fe2O3 : El elemento que acompaña al oxígeno es el hierro (Fe), es un metal. Por lo tanto es un óxido básico.
Oxígeno + Elemento Metálico → Óxido Básico
b) CO : El elemento que acompaña al oxígeno es el carbono (C), es un no metal. Por lo tanto es un óxido ácido.
Oxígeno + Elemento No Metálico → Óxido Ácido
Igualmente para los demás:
c) SO3 : El azufre (S) es un no metal, entonces es un óxido ácido
d) CuO: El cobre (Cu) es un metal, entonces es un óxido básico
e) NO2 : El nitrógeno (N), es un no metal, entonces es un óxido ácido
f) Na2O : El sodio (Na) es un metal, entonces es un óxido básico
g) MgO : El magnesio (Mg) es un metal, entonces es un óxido básico

ÓXIDOS ÁCIDOS
FORMACIÓN
Los metales se combinan con el oxígeno molecular para formar los óxidos básicos correspondientes. De igual manera ocurre con los No Metales.
Los óxidos ácidos o anhídridos están formados por la combinación de un No Metal y el Oxígeno molecular gaseoso. En forma simbólica: No Metal + O2 ----------------------> Óxido Ácido o Anhídrido
NOMENCLATURA
SISTEMATICA
La nomenclatura se aplica a la fórmula que ya está simplificada. El prefijo "mono" puede suprimirse; esto significa que si un elemento no tiene prefijo solo interviene un átomo de ese elemento en la misma fórmula.
Ejemplos:As2S3 (trisulfuro de diarsénico); PF5 (pentafluoruro de fósforo).
Stock
Los óxidos, tanto ácidos como básicos se nombran mediante las palabras "óxido de", seguida del nombre del elemento y un paréntesis donde se pone la valencia del elemento en números romanos, tal y como estaba al principio sin simplificar. Si un elemento tiene solo una valencia no se pone paréntesis.
Ejemplos:Fe2O3 (óxido de hierro III); SO3 (óxido de azufre (VI); FeO (óxido de hierro II); Na2O (óxido de sodio).
Tradicional
Para los óxidos básicos:
Si el metal con el que se combina tiene una sola valencia, se nombran con las palabras óxido de, y el nombre del metal con el que se combina.Ejemplos: CaO (óxido de calcio); Na2O (óxido de sodio).
Si el metal con el que se combina tiene dos valencias, se pone como en el de una valencia pero el nombre del metal acaba en oso cuando actúa con la valencia menor y en ico cuando actúa con la valencia mayor y se le quita el prefijo "de".
Ejemplos: FeO (óxido ferroso, el hierro tiene en este caso valencia 2 y se simplifica); Fe2O3 (óxido férrico, el hierro tiene en este caso valencia 3).
Para los óxidos ácidos:
Si el no metal con el que se combina tiene una sola valencia se nombran con las palabras óxido de, y el nombre del metal con el que se combina acabado en ico.Ejemplos: B2O3 (óxido bórico.
Si el no metal con el que se combina tiene dos o más valencias, se ponen al nombre las siguientes terminaciones:
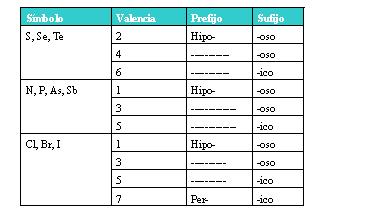
EJEMPLOS:
1,N2O5 Óxido de Nitrógeno (V)
2. TeO2 Oxido de Telurio (IV)
3.SO2 Óxido de Azufre (IV)
FORMULA
Al escribir la fórmula química de los óxidos no metálicos, se escribe primero el símbolo del elemento no metálico y a continuación el del oxígeno. Se colocan subíndices de acuerdo con el número deátomos que hay de cada elemento químico
Se expresa en símbolos los elementos Carbono y oxigeno.
CIV + O2 ---------> .................
Mediante la elaboración de la fórmula desarrollada, podemos expresar la fórmula molecular de dicho óxido ácido. Entonces: C + O2 -----------------> CO2
conclusión: con este trabajo aprendimos a analizar mediante definiciones y conceptos de los diferentes óxidos..todos los óxidos hidracidos estos sirven mucho en la vida ya sea en la industria o nuestra vida cotidiana
No hay comentarios:
Publicar un comentario