MÉTODO DE TANTEO Y OXIDO REDUCCIÓN:
INTRODUCCIÓN: Este método se basa en analizar por separado dos reacciones que son las reacciones de oxidación y las reacciones de reducción, las cuales se balancean y una vez estén balanceadas se suman con el fin de obtener la ecuación final balanceada..
Las reacciones de óxido-reducción, son reacciones químicas importantes que están presentes en nuestro entorno. La mayoría de ellas nos sirven para generar energía.
OBJETIVOS:El alumno practicara el balanceo de ecuaciones de oxido-reducción,utilizando el método de cambio de numero de oxidación.
MARCO TEÓRICO
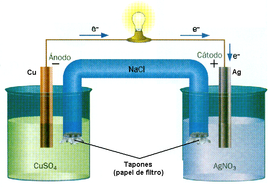
Oxido reducción
 Las reacciones de reducción-oxidación (también conocido como reacción redox) son las reacciones de transferencia de electrones. Esta transferencia se produce entre un conjunto de elementos químicos, uno oxidante y uno reductor (una forma reducida y una forma oxidada respectivamente).
Las reacciones de reducción-oxidación (también conocido como reacción redox) son las reacciones de transferencia de electrones. Esta transferencia se produce entre un conjunto de elementos químicos, uno oxidante y uno reductor (una forma reducida y una forma oxidada respectivamente).
Para que exista una reacción redox, en el sistema debe haber un elemento que ceda electrones y otro que los acepte:
* El reductor es aquel elemento químico que tiende a ceder electrones de su estructura química al medio, quedando con una carga positiva mayor a la que tenía.
* El oxidante es el elemento químico que tiende a captar esos electrones, quedando con carga positiva menor a la que tenía.
Cuando un elemento químico reductor cede electrones al medio se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que cuando un elemento químico capta electrones del medio se convierte en un elemento reducido, e igualmente forma un par redox con su precursor reducido
.
Dentro de una reacción global redox, se da una serie de reacciones particulares a las cuales se les llama semirreacciones o reacciones parciales.
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial de reducción, también llamado potencial redox.
Una titulación redox, es una en la que un indicador químico indica el cambio en el porcentaje de la reacción redox mediante el viraje de color entre el oxidante y el reductor.
La oxidación es una reacción química donde un compuesto cede electrones, y por lo tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de electrones
En química, reducción es el proceso electroquímico por el cual un átomo o ion gana electrones. Implica la disminución de su estado de oxidación. Este proceso es contrario al de oxidación.
Cuando un ión o átomo se reduce:
* Gana electrones
* Actúa como agente oxidante
* Es reducido por un agente reductor
* Disminuye su estado o número de oxidación
DESARROLLO DEL LABORATORIO:
CONCLUSIÓN:
VÍDEO REFERENTE





















No hay comentarios:
Publicar un comentario